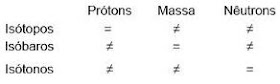domingo, 22 de janeiro de 2017
ISÓTOPOS, ISÓBAROS, ISÓTONOS
Classificamos os elementos como Isótopos, Isóbaros e Isótonos, conforme seus valores de Z (número atômico) e A (número de massa).
ISÓTOPOS: São átomos de elementos diferentes que apresentam o mesmo número atômico (Z) e número de massa (A) diferentes.
ISÓBAROS: São átomos de elementos diferentes que apresentam o mesmo número de massa (A) e número atômico (Z) diferentes.
ISÓTONOS: São átomos de elementos diferentes que apresentam diferentes número atômico (Z) e número de massa (A), mas o mesmo número de nêutrons.
A imagem a seguir mostra como não confundir as três classificações apresentadas.
Outra forma de não confundir é:
isótoPo => p=prótons = número atômico (Z)
isóbAro => A= número de massa
isótoNo => n= nêutrons
Então não há com o que se preocupar na hora de classificar átomos como Isótopos, Isóbaros ou Isótonos.
BIBLIOGRAFIA:
Sites:
1- https://www.todamateria.com.br/isotopos-isobaros-e-isotonos/
2- http://www.estudopratico.com.br/isotopos-isobaros-e-isotonos-classificacao-dos-atomos/
Livros:
1- Utimura, T.Y.: Linguanoto, M.: Química Fundamental, Volume Único, Pgs. 325 - 473, Editora FTD, São Paulo, 1998;
segunda-feira, 16 de janeiro de 2017
NOMENCLATURA DE COMPOSTOS ORGÂNICOS
Como sabemos, são muitos os tipos de compostos orgânicos e todos tem uma coisa em comum: suas estruturas são formadas por carbonos e hidrogênios. O que os diferem são suas FUNÇÕES ORGÂNICAS, e cada Função Orgânica contém uma parte que é chamada de GRUPO FUNCIONAL. Por meio deste Grupo Funcional, a quantidade de carbonos que formam a cadeia carbônica e se a cadeia carbônica é SATURADA (apenas ligações simples entre carbonos) ou INSATURADA (pelo menos uma ligação dupla ou tripla entre carbonos). Esta nomenclatura segue conforme a INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY (UNIÃO INTERNACIONAL DE QUÍMICA PURA E APLICADA), mais conhecida pela sigla IUPAC.
Segundo a IUPAC, a nomenclatura deve ser feita em três partes:
1- PREFIXO: No prefixo colocamos a quantidade de carbonos que formam a maior cadeia possível a partir do Grupo Funcional da molécula orgânica. Para cada quantidade de carbonos presentes na molécula temos um Prefixo diferente, como mostra a tabela a seguir:
QUANTIDADE
DE CARBONOS
|
PREFIXO
|
1
|
MET
|
2
|
ET
|
3
|
PROP
|
4
|
BUT
|
5
|
PENT
|
6
|
HEX
|
7
|
HEPT
|
8
|
OCT
|
9
|
NON
|
10
|
DEC
|
Lembrando que não para em 10 a quantidade de carbonos na molécula.
2- INFIXO: No infixo, colocamos se a cadeia carbônica da molécula é Saturada (Ligação simples entre carbonos) ou Insaturada (Ligações duplas ou triplas entre carbonos). Para as cadeias carbônicas Saturadas usamos o infixo AN, para as cadeias carbônicas Insaturadas usamos o infixo EN, para ligações duplas e o infixo IN, para ligações triplas.
3- SUFIXO: No sufixo, colocamos a nomenclatura do grupo funcional que está presente na molécula. A tabela a seguir mostra a nomenclatura dada para cada Grupo Funcional e, por consequência, da Função Orgânica a qual pertence.
FUNÇÃO
ORGÂNICA
|
SUFIXO
|
HIDROCARBONETO
|
O
|
ÁLCOOL
|
OL
|
ALDEÍDO
|
AL
|
CETONA
|
ONA
|
ÁCIDO CARBOXÍLICO
|
ÁCIDO + PREFIXO + INFIXO + ÓICO
|
AMINA
|
AMINA
|
AMIDA
|
AMIDA
|
No caso das Funções Orgânicas Éster e Éter há uma pequena diferença. A molécula das duas funções é formada por duas cadeias carbônicas, sendo assim cada cadeia terá uma nomenclatura diferente como mostra a próxima tabela.
FUNÇÃO
ORGÂNICA
|
SUFIXO
|
ÉSTER
|
PREFIXO + INFIXO + OATO DE PREFIXO +
INFIXO + ILA
|
ÉTER
|
PREFIXO + INFIXO + ÓXI – PREFIXO +
INFIXO + O
|
Para vocês verem que não é complicado nomear moléculas orgânicas vou demonstrar
OCTANO (GASOLINA)
ETANOL (ÁLCOOL COMBUSTÍVEL/LIMPEZA)
PROPANONA (ACETONA)
ÁCIDO ETANÓICO (ÁCIDO ACÉTICO/ VINAGRE)
METANAL (FORMALDEÍDO/ FORMOL)
PROPANOATO DE ETILA
METÓXI-ETANO
METILAMINA (ODOR DE PEIXE)
PROPANAMIDA
BIBLIOGRAFIAS:
Livros:
1- Utimura, T.Y.: Linguanoto, M.: Química Fundamental, Volume Único, Pgs. 325 - 473, Editora FTD, São Paulo, 1998;
2- Fonseca, M. R. M. da:Química:meio ambiente,cidadania, tecnologia, 1ª ed., Volume 3, Pgs 20 - 21, Editora FTD, São Paulo, 2010.
3- Ser Protagonista: Química, 3º Ano Ensino Médio, Obra Coletiva Concebida, Desenvolvida e Produzida por Edições SM; Editor Responsável: Antunes, M. T.; 2ª ed., Pgs 13;15;24, Edições SM, São Paulo, 2013.